
Benzophenon
| Sicherheitshinweise | |||||||
|---|---|---|---|---|---|---|---|
| |||||||
Benzophenon (IUPAC-Name Diphenylmethanon) ist eine organische Verbindung, die zu den Gruppen der Ketone und Aromaten zählt. Natürlich kommt Benzophenon als Geruchskomponente in Trauben vor.[5]
| Strukturformel | ||
|---|---|---|
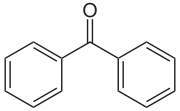
| ||
| Allgemeines | ||
| Name | Benzophenon | |
| Andere Namen | ||
| Summenformel | C13H10O | |
| Kurzbeschreibung | farbloser Feststoff mit geranienartigem Geruch[2] | |
| Externe Identifikatoren/Datenbanken | ||
| CAS-Nummer | | |
| EG-Nummer | 204-337-6 | |
| ECHA-InfoCard | | |
| PubChem | | |
| ChemSpider | | |
| DrugBank | | |
| Eigenschaften | ||
| Molare Masse | 182,22 g/mol−1 | |
| Aggregatzustand | fest | |
| Dichte | 1,111 g/cm3 (bei 18 °C)[2] | |
| Schmelzpunkt | 49 °C[2] | |
| Siedepunkt | 305 °C[2] | |
| Löslichkeit |
| |
Gewinnung und Darstellung
Im Labor kann Benzophenon ausgehend von Benzol dargestellt werden. Dieses wird zunächst mit Tetrachlormethan in Gegenwart von Aluminiumchlorid (AlCl3) bei Temperaturen von 5–10 °C in einer doppelten Friedel-Crafts-Alkylierung zu Diphenyldichlormethan umgesetzt. Eine nachfolgende Hydrolyse dieses Zwischenprodukts liefert schließlich Benzophenon.[6]
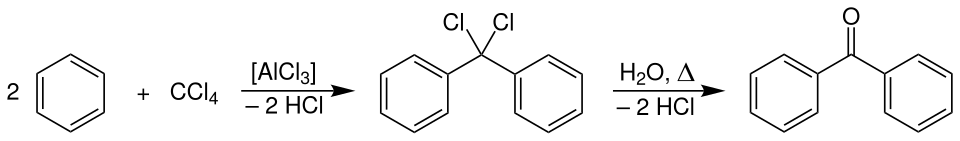
Weiterhin ist auch die Friedel-Crafts-Acylierung von Benzol mit Benzoylchlorid in Anwesenheit einer Lewis-Säure (z. B. Aluminiumchlorid) möglich.[3] Die letztgenannte Methode erlaubt die Synthese von unsymmetrisch substituierten Benzophenonen in sehr hohen Ausbeuten.[7]
Eigenschaften
Physikalische Eigenschaften
Benzophenon bildet farblose rhombische Kristalle, die bei 49 °C schmelzen. Unter Normaldruck siedet die Verbindung bei 305 °C.[2] Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,36238, B = 2116,372 und C = −93,43 im Temperaturbereich von 474 bis 579 K[8] Die wichtigsten thermodynamischen Eigenschaften sind in der folgenden Tabelle aufgelistet:
| Eigenschaft | Typ | Wert [Einheit] |
|---|---|---|
| Standardbildungsenthalpie | ΔfH0gas ΔfH0solid |
49,9 kJ/mol[9] −34,48 kJ/mol[9] |
| Verbrennungsenthalpie | ΔcH0solid | −6510.3 kJ/mol[9] |
| Wärmekapazität | cp | 224,80 J·mol−1·K−1 (25 °C)[10] als Feststoff |
| Schmelzenthalpie | ΔfH0 | 18,194 kJ/mol[10] beim Schmelzpunkt |
| Schmelzentropie | ΔfS0 | 56,67 J·mol−1·K−1[10] beim Schmelzpunkt |
| Verdampfungsenthalpie | ΔVH0 | 94,977 kJ/mol[11] bei 25 °C |
| Kritische Temperatur | TC | 830 K[12] |
| Kritischer Druck | PC | 33,52 bar[12] |
| Kritische Dichte | ρC | 1,762 mol/l[12] |
Verwendung
Benzophenon wird als Photoinitiator in UV-Härtungs-Anwendungen, wie Tinten und Beschichtungen in der Druckindustrie, verwendet.
Als Inhaltsstoff in Kosmetika schützt es Duftstoffe und Farben in Produkten wie Cremes, Parfüms, Seifen oder aber Kunststoffverpackungen vor Zerstörung durch UV-Strahlung.[3] Auch als blumiger Riechstoff findet es Verwendung.[13][5] Im Labormaßstab findet es als Indikator bei der Trocknung von organischen Lösungsmitteln mit Natrium Anwendung. Dieses reduziert Benzophenon zum tiefblauen Ketylradikal, welches in Abwesenheit von Wasser und Sauerstoff mäßig stabil ist.[3]
Derivate
Es werden verschiedene Derivat des Benzophenons durch INCI als BENZOPHENONE bezeichnet. 2,2′,4,4′-Tetrahydroxybenzophenon[14] wird unter der Bezeichnung „BENZOPHENONE-2“ geführt. Oxybenzon („BENZOPHENONE-3“), ist nach der deutschen Kosmetik-Verordnung als UV-Schutz in Sonnencremes zugelassen. Es kann allergisierend wirken.[15] Sulisobenzon (auch „BENZOPHENONE-4“) ist ebenfalls als Bestandteil von Sonnencremes als UV-B- und UV-A- Schutz zugelassen.[16] Bis(2-hydroxy-4-methoxyphenyl)methanon[17] wird unter der Bezeichnung „BENZOPHENONE-6“ geführt.
Sicherheitshinweise
Die Internationale Agentur für Krebsforschung (IARC) stufte Benzophenon im Jahr 2013 als möglicherweise krebserzeugend ein.[18]
Benzophenon wurde 2013 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Benzophenon waren die Besorgnisse bezüglich Verbraucherverwendung, hohes Risikoverhältnis (Risk Characterisation Ratio, RCR) und weit verbreiteter Verwendung sowie der Gefahren ausgehend von einer möglichen Zuordnung zur Gruppe der CMR-Stoffe. Die Neubewertung fand ab 2013 statt und wurde von Dänemark durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[19][20]
Einzelnachweise
- ↑ Eintrag zu
 BENZOPHENONE
in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. Oktober 2025.
BENZOPHENONE
in der CosIng-Datenbank der EU-Kommission, abgerufen am 3. Oktober 2025.
- ↑ Hochspringen nach: a b c d
e f g h Eintrag zu
 Benzophenon in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 3. Oktober 2025. (JavaScript erforderlich)
Benzophenon in der GESTIS-Stoffdatenbank
des Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung, abgerufen am 3. Oktober 2025. (JavaScript erforderlich)
- ↑ Hochspringen nach: a b c d
Eintrag zu
 Benzophenon. In: Römpp Online. Georg Thieme Verlag,
abgerufen am3. Oktober 2025.
Benzophenon. In: Römpp Online. Georg Thieme Verlag,
abgerufen am3. Oktober 2025.
- ↑ Eintrag zu
 Benzophenon in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA),
abgerufen am3. Oktober 2025. Hersteller bzw. Inverkehrbringer können
die harmonisierte Einstufung und Kennzeichnung
Benzophenon in der Datenbank ECHA CHEM der Europäischen Chemikalienagentur (ECHA),
abgerufen am3. Oktober 2025. Hersteller bzw. Inverkehrbringer können
die harmonisierte Einstufung und Kennzeichnung  erweitern.
erweitern.
- ↑ Hochspringen nach: a b Karl‐Georg Fahlbusch, Franz‐Josef Hammerschmidt, Johannes Panten, Wilhelm Pickenhagen,
Dietmar Schatkowski, Kurt Bauer, Dorothea Garbe, Horst Surburg: Flavors and Fragrances. In: Ullmann’s Encyclopedia of Industrial Chemistry.
Band 15, 2012, S. 126,
doi:
 10.1002/14356007.a11_141.
10.1002/14356007.a11_141.
- ↑ C. S. Marvel, W. M. Sperry:
 Benzophenone
In: Organic Syntheses. 8, 1928, S. 26,
doi:
Benzophenone
In: Organic Syntheses. 8, 1928, S. 26,
doi:  10.15227/orgsyn.008.0026; Coll. Vol. 1, 1941, S. 95
(
10.15227/orgsyn.008.0026; Coll. Vol. 1, 1941, S. 95
(  PDF).
PDF).
- ↑ C.-W. Schellhammer In: Klaus-Dieter Bode, Eugen Müller, Josef Houben, Theodor Weyl (Hrsg.): Methoden der Organischen Chemie. Band 7/2a, Thieme-Verlag 1973, ISBN 3-13-206004-6, S. 15.
- ↑ R. R. Dreisbach, S. A. Shrader: Vapor Pressure-Temperature Data on Some Organic Compounds. In: Ind. Eng. Chem. 41, 1949, S. 2879–2880,
 doi:10.1021/ie50480a054.
doi:10.1021/ie50480a054.
- ↑ Hochspringen nach: a b c R. Sabbah, M. Laffitte:
Etude thermodynamique de la molecule de benzophenone. In: Thermochim. Acta. 23, 1978, S. 196–198,
 doi:10.1016/0040-6031(78)85128-4.
doi:10.1016/0040-6031(78)85128-4.
- ↑ Hochspringen nach: a b c C. G. DeKruif, J. C. Van Miltenburg,
J. G. Blok: Molar heat capacities and vapour pressures of solid and liquid benzophenone. In: J. Chem. Thermodyn. 15, 1983, S. 129–136,
 doi:10.1016/0021-9614(83)90151-9.
doi:10.1016/0021-9614(83)90151-9.
- ↑ K. Neumann, E. Volker: Eine Drehwaagemethode zur Messung kleinster Dampfdrücke. In: Z. Phys. Chem. 161, 1932, S. 33–45.
- ↑ Hochspringen nach: a b c W. V. Steele, R. D. Chirico, I. A. Hossenlopp, S. E. Knipmeyer, A. Nguyen, N. K. Smith: DIPPR project 871. Determination of ideal-gas enthalpies of formation for key compounds. The 1990 project results, Experimental Results for DIPPR 1990-91 Projects on Phase Equilibria and Pure Component Properties. In: DIPPR Data Ser. Nr. 2, 1994, S. 188–215.
- ↑ Dieter Martinetz, R. Hartwig: Taschenbuch der Riechstoffe: Ein Lexikon von A bis Z, Verlag Harri Deutsch, Thun und Frankfurt/Main 1998, ISBN 3-8171-1539-3.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu 2,2′,4,4′-Tetrahydroxybenzophenon:
CAS-Nr.:
 131-55-5,
EG-Nr.: 205-028-9,
ECHA-InfoCard:
131-55-5,
EG-Nr.: 205-028-9,
ECHA-InfoCard:  100.004.573,
PubChem:
100.004.573,
PubChem:  8571,
ChemSpider:
8571,
ChemSpider:  8253
8253
- ↑ A. Darvay, I. R. White, R. J. Rycroft, A. B. Jones, J. L. Hawk, J. P. McFadden: Photoallergic contact dermatitis is uncommon. In: Br J Dermatol. 145(4),
2001, S. 597–601.
 PMID 11703286.
PMID 11703286.
- ↑ G. J. Nohynek, H. Schaefer: Benefit and risk of organic ultraviolet filters. In: Regul. Toxicol.
Pharmacol. Band 33, Nr. 3, 2001,
S. 285–299,
doi:
 10.1006/rtph.2001.1476,
10.1006/rtph.2001.1476,
 PMID 11407932.
PMID 11407932.
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Bis(2-hydroxy-4-methoxyphenyl)methanon:
CAS-Nr.:
 131-54-4,
EG-Nr.: 205-027-3,
ECHA-InfoCard: 100.004.572,
PubChem:
131-54-4,
EG-Nr.: 205-027-3,
ECHA-InfoCard: 100.004.572,
PubChem:  8570,
ChemSpider:
8570,
ChemSpider:  8252.
8252.
- ↑ Some chemicals present in industrial and consumer products, food and drinking-water (= IARC
monographs on the evaluation of carcinogenic risks to humans. Nr. 101). International agency for research on cancer, Lyon 2013,
ISBN 978-92-832-1324-6 (
 iarc.fr).
iarc.fr).
- ↑ Europäische Chemikalienagentur (ECHA):
 Substance Evaluation Conclusion and Evaluation Report, 2018.
Substance Evaluation Conclusion and Evaluation Report, 2018.
- ↑ Community Rolling Action Plan (CoRAP) der Europäischen Chemikalienagentur (ECHA):
 Benzophenone,
abgerufen am 3. Oktober 2025.
Benzophenone,
abgerufen am 3. Oktober 2025.


© biancahoegel.de
Datum der letzten Änderung: Jena, den: 03.10. 2025
